- Home
- NUTRALICA® Healthcare Institute
- Dossiers scientifiques
- Acides Aminés : la Carnitine
- Acides Aminés : la Taurine
- Acides gras essentiels
- Antioxydants
- Antioxydants : la Lutéine
- Antioxydants : La Grenade
- Antioxydants et Stress Oxydant
- Antioxydants : le Coenzyme Q10
- Antioxydants : le Glutathion réduit
- Lipides
- Magnésium Acétyltaurinate : ATA Mg
- Vitamines antioxydantes
- Contact
- Banque de données
POUR MIEUX COMPRENDRE LES LIPIDES

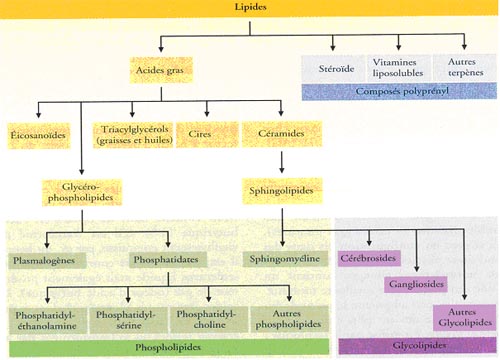
Structure des lipides
Les lipides sont définis comme les dérivés naturels d'acides gras, résultant de leur condensation avec des alcools ou des amines. Leur caractère principal est l'hydrophobicité : l'abondance de chaînes carbonées et le petit nombre d'atomes électronégatifs (O,N,S,P) conduit à des structures non polaires ne pouvant pas interagir avec l'eau. Cette hydrophobicité est à la base de plusieurs propriétés: insolubilité dans l'eau et solubilité dans les solvants organiques, stockage d'énergie sous une forme compacte, solubilisation de composés hydrophobes liposolubles (arômes, vitamines, polluants), réalisation d'édifices lipidiques complexes (lipoprotéines, membranes) sans aucune liaison covalente entre les molécules constitutives.
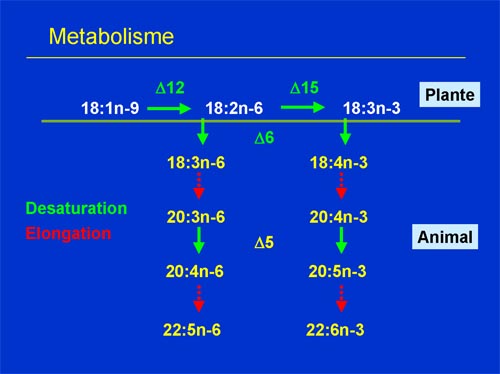
Bien que peu abondants à l'état libre, les acides gras sont responsables des principales caractéristiques des lipides. Ils sont définis par une fonction carboxylique (acide faible), une chaîne hydrocarbonée de longueur variable et la présence éventuelle d'une ou plusieurs doubles liaisons dont la configuration géométrique naturelle est "cis". Deux acides gras insaturés (acide linoléique et linolénique) ne sont pas synthétisables par l'homme et doivent être apportés par l'alimentation.
La liaison des acides gras aux fonctions alcools du glycérol conduit aux triacylglycérols, composés majoritaires des graisses animales et végétales.
La fonction "sn"3 d'un diacylglycérol peut être liée à un groupe phosphorylcholine, définissant les lécithines qui sont les plus abondants des glycérophospholipides. A la place de la choline, on peut trouver l'éthanolamine, la sérine ou un polyalcool cyclique, l'inositol. Ces groupements sont polaires et peuvent interagir avec l'eau.
Les phospholipides s'organisent facilement en films monomoléculaires ayant un rôle d'interface entre une phase aqueuse et une phase lipidique ou en double couche, comme dans les membranes cellulaires.
Dans toutes les molécules lipidiques, la présence de doubles liaisons en configuration " cis " gêne les interactions hydrophobes entre les chaînes d'acides gras et empêche une organisation compacte des molécules: ceci retentit sur le point de fusion et de nombreuses propriétés fonctionnelles (fluidité, action des enzymes).
Digestion des lipides
La digestion regroupe un ensemble de réactions d'hydrolyse catalysées par des enzymes spécifiques qui transforment les lipides alimentaires, non absorbables, en molécules plus simples absorbables.
La digestion des triglycérides (TG) débute dans la bouche (par la lipase linguale) et s'achève dans le duodénum (par la lipase pancréatique et son cofacteur, la co-lipase pancréatique).
Les TG dont les acides gras (AG) contiennent 4 et 6 atomes de carbonne ("chaînes courtes") ou 8 à 12 atomes de carbone ("chaînes moyennes") sont hydrolysés plus rapidement par ces 2 lipases que les TG à "chaînes longues" (AG à plus de 12 atomes de carbone). Le résultat final est la formation majoritairement d'AG libres (AGL) et de 2-monoglycérides (2-MG, dans lesquels l'AG unique est estérifié sur le carbone N° 2 du glycérol) et de faibles proportions de glycérol provenant de l'hydrolyse d'une faible partie des MG. Les phospholipides (PL) sont hydrolysés uniquement dans le duodénum par la phospholipase A2 pancréatique qui libère exclusivement l'un (celui estérifié sur le carbone N° 2 du glycérol des PL) des deux AG présents et forme un lysophospholipide (LPL). Dans le duodénum, la carboxyl-ester-hydrolase pancréatique hydrolyse les esters de cholestérol (en AGL + cholestérol) et les esters de vitamines liposolubles (en AGL + vitamines-alcool).
Les AG à chaînes courtes libérés dans l'estomac, ou dans le duodénum, sont directement absorbés au niveau, respectivement, de la muqueuse stomacale ou jéjunale ; ils passent dans le sang où ils se lient à la sérum albumine et atteignent directement le foie. Les AGL à chaînes longues et tous les autres lipides issus de la digestion sont absorbés uniquement au niveau de la muqueuse du jéjunum. De plus, étant hydrophobes, leur absorption est conditionnée par leur solubilisation préalable au sein des micelles de sels biliaires. Une fois dans l'entérocyte, les AGL à chaînes longues, après activation, estérifient les 2-MG en TG, les LPL en PL et une partie du cholestérol (CH) en ester de cholestérol (ECH). Ces divers lipides sont alors rassemblés dans l'entérocyte en structures pluri-moléculaires appelées chylomicrons. Ceux- ci sont composés d'un noyau central hydrophobe (TG + ECH + vitamines liposolubles) entouré d'une enveloppe de molécules amphipatiques de PL, CH, protéines spécifiques (apo-protéines). Les chylomicrons quittent l'entérocyte, passent dans la circulation lymphatique puis dans le sang où ils seront métabolisés.
Transport des lipides par les lipoprotéines
Les lipides sont des constituants indispensables des tissus qui les utilisent comme composants membranaires, pour stocker l'énergie (adipocytes), comme sources d'énergie (cellules musculaires et hépatiques) ou comme précurseurs pour des synthèses spécialisées (hormones stéroïdes, prostaglandines, etc...).
Ces lipides apportés par l'alimentation ou synthétisés par le foie sont insolubles dans le milieu aqueux plasmatique. Ils circulent donc d'un tissu à l'autre associés à des protéines sous forme de lipoprotéines. Ces protéines vont jouer un rôle très important dans le métabolisme intravasculaire des lipoprotéines.
Les lipides alimentaires absorbés au niveau intestinal sont sécrétés sous forme de chylomicrons, très riches en triglycérides. Ces triglycérides sont hydrolysés dans le plasma par la lipoprotéine lipase et les particules résiduelles contenant le cholestérol alimentaire, sont captées par le foie.
Les lipides endogènes synthétisés par le foie sont sécrétés sous forme de VLDL riche en triglycérides. L'action de la lipoprotéine lipase conduit à la formation d'IDL, particules plus petites, qui seront captées par le foie ou transformées dans le plasma en LDL principal transporteur de cholestérol par les cellules.
Les LDL sont captées par les tissus en fonction de leurs besoins en cholestérol ou par le foie, seul organe capable d'éliminer le cholestérol. La captation des LDL par les cellules se fait par un mécanisme spécifique d'endocytose par des récepteurs dont l'expression est régulée par le cholestérol intracellulaire.
Les HDL peuvent capter le cholestérol cellulaire excédentaire et le transférer dans le plasma aux autres lipoprotéines qui le ramènent au foie.
Dans le foie, le cholestérol peut être transformé en acides biliaires et être éliminé. Moins il i y a de cholestérol dans le foie, plus le foie peut capter des LDL (stimulation des récepteurs LDL). Inversement, tout excès d'apport alimentaire de cholestérol et de synthèse endogène du cholestérol vont conduire à augmenter la concentration des LDL plasmatiques (hypercholestérolémie athérogène).
D'autres facteurs peuvent influencer la cholestérolémie (hormones, etc...). n a aussi été démontré que l'apport alimentaire d'acides gras insaturés pouvaient conduire à une diminution de la cholestérolémie.
Métabolisme intracellulaire des acides gras
Les acides gras pris en charge par des protéines spécifiques à l'intérieur de la cellule sont activés par fixation sur le coenzyme A, puis pénètrent à l'intérieur de la mitochondrie, grâce au système navette de la carnitine s'ils sont à longue chaîne. Ils sont oxydés par la répétition de 4 réactions qui libèrent des fragments dicarbonés sous forme d'acétyl-coenzyme A. La stéréospécificité précise des réactions impose l'intervention d'enzymes supplémentaires pour la dégradation des acides gras insaturés. L'oxydation complète des acétyl-coenzymes A par le cycle tricarboxylique de Krebs et la régénération par la chaîne respiratoire des coenzymes réduits au cours de l'oxydation permet la récupération d'énergie sous forme d'ATP. La production d'ATP excède généralement les besoins de la cellule hépatique: une partie des acétyl-coenzymes A produits dans ce tissu est transformée en corps cétoniques (acétoacétate et hydroxybutyrate) utilisés comme source d'énergie par les tissus extra-hépatiques. La synthèse des acides gras saturés est cytosolique, à partir d'acétyl-coenzymes A et de coenzymes réduits fournis par le métabolisme glucidique. Elle fait intervenir deux complexes multienzymatiques, l'acétyl-coenzyme A carboxylase, jouant un rôle important dans la régulation de la synthèse, et l'acide gras synthétase.
En situation d'abondance glucidique (état nourri), les atomes de carbone du glucose sont facilement incorporés dans les acides gras néoformés.
En situation de pénurie glucidique, le métabolisme est orienté vers l'oxydation des acides gras et la production de corps cétoniques; les atomes de carbone des acides gras ne sont pas incorporés dans les glucides, mais une partie de l'énergie produite par l'oxydation des acides gras peut être utilisée par la néoglucogénèse à partir d'autres substrats glucoformateurs (lactate, glycérol, acides aminés).
Métabolisme et régulation cellulaires
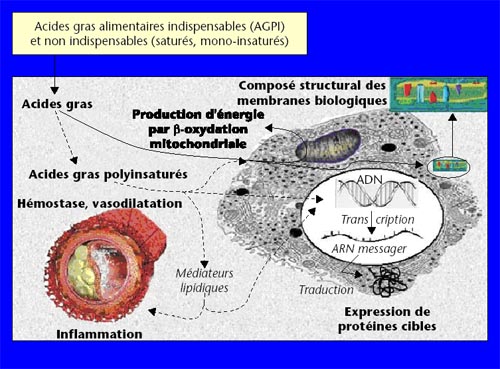
La plus grande part des lipides alimentaires est constituée d'acides gras estérifiés. Alors que les acides saturés et monoinsaturés sont partiellement utilisés par l'organisme à des fins énergétiques, les acides gras polyinsaturés (AGPI) jouent un rôle structural dans les membranes cellulaires et peuvent intervenir dans la régulation des fonctions cellulaires en réponse aux agents qui les activent sélectivement. Parmi les AGPI importants, l'acide arachidonique (AA) est le mieux connu pour ses qualités de précurseurs de médiateurs lipidiques. Dans les phases initiales d'activation cellulaire, l'AA est libéré des phospholipides membranaires sous l'action de phospholipases spécifiques, puis oxygéné par des enzymes, appelées dioxygénases, qui conduisent à des dérivés de grande activité biologique: prostanoïdes et leucotriènes par exemple.
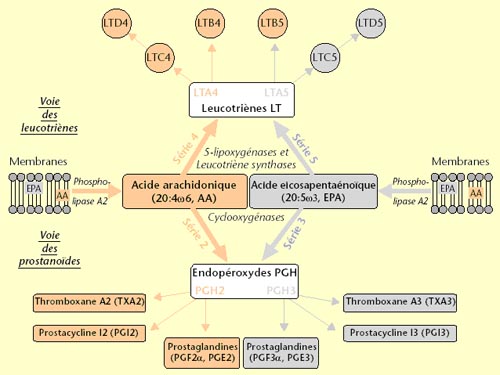
D'autres AGPI, généralement mineurs quantitativement, peuvent être apportés à ces cellules dans des conditions nutritionnelles particulières. Ils peuvent alors interférer avec le métabolisme normal de l'AA, et par conséquent modifier l'activation cellulaire spécifique, et/ou agir sur le fonctionnement cellulaire par leurs propres produits oxygénés. Les exemples les mieux connus sont sans doute ceux de l'acide eicosapentaénoïque (EPA), et de l'acide docosahexaénoïque (DHA), ingérés en quantité substantielle notamment dans les graisses de poisson.
Références bibliographiques sur demande à Cette adresse e-mail est protégée contre les robots spammeurs. Vous devez activer le JavaScript pour la visualiser.
Copyright Nutralica 2001 - 2023 | Mentions Légales | Politique de confidentialité
Ce site n'est pas un site médical. Les informations ne peuvent en aucun cas se substituer à une consultation chez un professionnel de la santé
This website uses cookies to manage authentication, navigation, and other functions. By using our website, you agree that we can place these types of cookies on your device.
You have declined cookies. This decision can be reversed.
You have allowed cookies to be placed on your computer. This decision can be reversed.